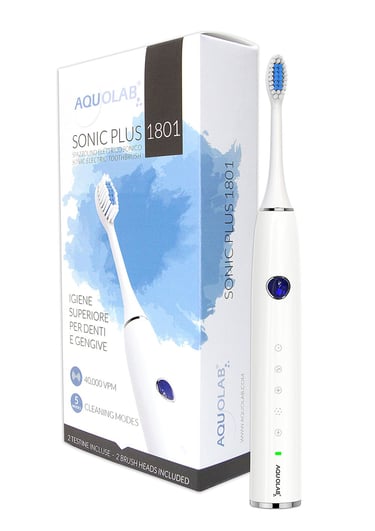
distRibuteur exclusif des produits Aquolab en france, DOM-COM, belgique et suisse.
La parodontie et les maladies parodontales
Les maladies parodontales sont des infections bactériennes des gencives entrainant la destruction des tissus de support de la dent. Le jet dentaire Aquolab à l'ozone permet de lutter contre ces infections et vous permet d'avoir une hygiène quotidienne irréprochable.
M.A Houle, D Grenier
1/4/20269 min lire
La parodontie est une spécialité de la dentisterie pour soigner les maladies parodontales comme la gingivite ou la parodontite.
Voici un article portant sur les connaissances actuelles concernant les maladies parodontales :
Maladies parodontales : connaissances actuelles
M.A Houle, D Grenier.
Groupe de recherche en écologie buccale, faculté de médecine dentaire, université Laval, Québec G1K 7P4, Canada
Received 27 January 2003, Accepted 24 March 2003, Available online 2 July 2003.
Source : https://www.sciencedirect.com/
Résumé
Les maladies parodontales sont des infections bactériennes mixtes qui entraînent la destruction des tissus de support de la dent. Des études épidémiologiques ont révélé qu’environ 10 % de la population est atteinte de la forme sévère et généralisée. Trois espèces bactériennes à Gram négatif retrouvées dans la plaque dentaire, soit Porphyromonasgingivalis, Bacteroidesforsythus et Actinobacillusactinomycetemcomitans, ont pu être fortement associées à ces maladies. Ces bactéries parodontopathogènes possèdent différents facteurs de virulence leur permettant de coloniser les sites sous-gingivaux, d’échapper au système de défense de l’hôte et de créer des dommages tissulaires. La réponse immunitaire de l’hôte, en réponse à l’agression bactérienne constante, est un facteur déterminant dans la progression de la maladie. Un certain nombre de cytokines (IL–1, IL–6, IL–8, TNF–α), de médiateurs de l’inflammation (PGE2) et de métalloprotéinases matricielles (MMP–2, MMP–3, MMP–8, MMP–9) ont été associés à la progression des parodontites. Enfin, des études récentes ont suggéré la participation possible de certains virus (cytomégalovirus, virus Epstein–Barr) dans l’étiopathogenèse des parodontites. Les traitements classiques proposés pour les parodontites ont pour but d’éliminer par détartrage et surfaçage radiculaire le facteur étiologique primaire soit la plaque bactérienne. De nouvelles approches visant à moduler la réponse inflammatoire de l’hôte ont récemment été développées et pourraient s’avérer utile dans le traitement des parodontites agressives et parodontites qui s'avèrent réfractaires aux thérapies conventionnelles. Cette revue de littérature a pour but de faire une mise à jour sur les connaissances actuelles des maladies parodontales en regard de l’épidémiologie, du diagnostic, de l’étiopathogenèse et des traitements.
1. Définition et classification
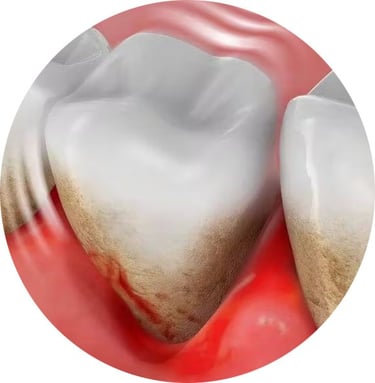
La maladie parodontale est observée sous 2 formes classiques : la gingivite et la parodontite. La gingivite est une inflammation localisée, limitée à la gencive libre et n’entraîne pas de destruction des tissus de support sous-jacents. Elle est associée à un changement quantitatif de la flore bactérienne locale et est considérée comme réversible. La parodontite quant à elle désigne la destruction de l’ensemble des tissus de support de la dent incluant l’os alvéolaire, le ligament parodontal et le cément (Fig. 1) [1], conséquence d’une infection mixte causée par un groupe spécifique de bactéries et de la réponse immunodestructrice de l’hôte. La parodontite peut être contrôlée, quoique l’on ne puisse parler de guérison proprement dite.
Fig. 1. Manifestation clinique de la parodontite. Modifié et reproduit avec la permission de Wilson et Kornman [1].
Le diagnostic de la parodontite repose principalement sur les caractéristiques cliniques, bien que des différences au niveau de la composition de la flore sous-gingivale puissent être observées [2]. En 1989, le World Workshop on ClinicalPeriodontics a proposé une classification des différentes formes de parodontites : la parodontite de l’adulte, les parodontites d’apparition précoce (parodontite prépubertaire, parodontite juvénile, parodontite à progression rapide), la parodontite associée à des désordres systémiques, la parodontite ulcéronécrosante et la parodontite réfractaire [3]. Cependant, cette classification comportait 2 lacunes importantes. En effet, aucune section ne portait sur le diagnostic des gingivites et le diagnostic des parodontites était dicté par l’âge du patient plutôt que par le patron de progression de la maladie. Plus récemment en 1999, l’International Workshop for a Classification of PeriodontalDiseases and Conditions a modifié certains paramètres afin de mieux définir la classification actuelle de l’ensemble des maladies parodontales [4]. De plus, une section portant sur le diagnostic des gingivites a été ajoutée. Ainsi, on distingue maintenant les gingivites causées par la plaque bactérienne et celles qui ne sont pas causées par la plaque. Les parodontites peuvent quant à elles être chroniques, agressives, d’origine systémique, ulcéronécrosantes, entraînant la formation d’abcès du parodonte ou associées à des lésions endodontiques ou développementales (acquise s).
La parodontite progresse par phases cycliques d’exacerbation, de rémission et de latence [5], [6], [7]. La présence de poches parodontales n’est pas considérée comme un indicateur de l’activité de la maladie mais représente plutôt la somme de la destruction parodontale engendrée par des périodes d’exacerbation passées. La cyclicité observée serait en étroite relation avec l’efficacité de la réponse immunitaire de l’hôte. Cependant, la progression intermittente observée pourrait dans certains cas s’expliquer par l’imprécision du sondage. En effet, pour qu’un site soit considéré en phase active de destruction, une perte d’attache de 2 à 3 mm entre 2 examens doit être observée. Il est donc difficile sinon impossible dans ces conditions de repérer les sites où la perte d’attache est lente. L’utilisation d’outils de mesure plus précis comme la sonde électronique a permis de démontrer qu’une perte d’attache progressive était observée chez 76 % des patients [8]. De leur côté Badersten et al. [9] ont identifié 7 types de patron de progression de perte d’attache. Il semble que la grande majorité des sites (73 %), plus particulièrement les sites profonds, démontrent une perte d’attache graduelle alors que les sites peu profonds subissent une perte d’attache initiale suivie d’une période de latence sans perte d’attache. La parodontite peut donc progresser de façon cyclique ou progressive.
2. Diagnostic
Le diagnostic de la maladie parodontale est établi après l’analyse des informations provenant de l’examen parodontal complet. Celui-ci comprend un questionnaire médical et dentaire, un examen clinique et radiologique ainsi que des tests diagnostiques supplémentaires si nécessaire. Le questionnaire médical permet d’identifier les conditions qui peuvent influencer la progression, le traitement et le pronostic de la maladie parodontale. De plus, certaines informations obtenues dans ce questionnaire peuvent influencer le type d’approche (grossesse, hypertension, diabète, abus d’alcool et de drogue). Le questionnaire dentaire permet d’identifier certaines habitudes, tel le tabagisme, qui peuvent avoir des répercussions néfastes sur le parodonte. Il permet également d’identifier la plainte principale ainsi que les traitements parodontaux administrés antérieurement. L’examen clinique comprend un examen extra-oral et intra-oral des structures anatomiques de l’appareil masticateur ainsi qu’un examen dentaire. L’examen parodontal proprement dit comporte entre autres l’évaluation de la présence et de la distribution de la plaque et du tartre, de la condition gingivale, de la profondeur au sondage, de la mobilité dentaire et de la présence de récessions gingivales et de furcations. Les radiographies permettent d’évaluer la condition actuelle du patient et servent de référence pour le suivi. Enfin, pour établir un bon diagnostic, il faut être en mesure d’évaluer l’absence ou la présence d’inflammation, le patron et l’extension de la perte d’attache, l’âge du patient lors de l’apparition des premiers symptômes, la vitesse de la progression et la présence ou l’absence de signes et symptômes (douleur, ulcération, plaque, tartre).
Dans certains cas des tests diagnostiques supplémentaires peuvent s’avérer utiles au clinicien. La microscopie à contraste de phase est parfois utilisée et permet d’identifier les bactéries selon leur morphotype (bâtonnets motiles, spirochètes, coques, filaments, etc.). Bien que la maladie parodontale soit souvent associée à une augmentation du nombre de bâtonnets motiles et de spirochètes, plusieurs pathogènes fortement associés à la maladie comme Actinobacillusactinomycetemcomitans, Bacteroidesforsythus et Porphyromonasgingivalis ne présentent pas ces caractéristiques. Bien qu’elle puisse s’avérer utile pour la motivation du patient, la microscopie à contraste de phase ne devrait pas être utilisée comme un outil diagnostique [10].
La culture de la flore bactérienne peut être intéressante, mais elle nécessite plusieurs précautions. Les échantillons recueillis doivent être immédiatement placés dans un milieu de transport exempt d’oxygène puisque la majorité des bactéries parodontopathogènes sont anaérobies strictes. Les échantillons doivent être analysés peu de temps après leur récolte pour éviter qu’il y ait perte de viabilité. La culture peut être combinée à un antibiogramme. De façon générale, il est suggéré de procéder à des tests de susceptibilité aux antibiotiques afin de cibler la médication la plus appropriée pour combattre l’infection. Une étude récente a démontré que des échantillons prélevés chez 25 patients et évalués par différents laboratoires ont abouti à des recommandations de traitements similaires [11]. Enfin, cette technique d’analyse est longue, fastidieuse et coûteuse. Elle est plus appropriée en recherche que dans le but d’obtenir un diagnostic clinique [12]. Un certain nombre de tests diagnostiques fondés sur l’utilisation d’anticorps de même que de sondes d’ADN hautement spécifiques à certaines espèces bactériennes parodontopathogènes ont récemment été développés [13], [14]. Quoique ces tests qui démontrent une spécificité et une sensibilité élevées puissent être réalisés en cabinet dentaire, certaines compagnies privées offrent le service d’analyse aux cliniques dentaires.
Enfin, des tests diagnostiques fondés sur une détection de produits bactériens (activité pseudotrypsine, dérivés sulfurés) ou de l’hôte (aspartate aminotransférase, collagénase, élastase) ont déjà été proposés mais des études additionnelles sont nécessaires pour démontrer leur sensibilité et leur spécificité [15], [16], [17].
tite.(…) Pour voir la totalité de l’article : https://www.sciencedirect.com/science/article/pii/S0399077X03002038
Références
[1]
T.G Wilson, K.S Kornman
The periodontium in health and disease
T.G Wilson, K.S Kornman (Eds.), Fundamentals of periodontitis, Carol Stream: Quintessence Books (1996), pp. 281-283
[2]
The American Academy of Periodontology
Diagnosis of periodontaldiseases. Committee on Research, Sciences and Therapy
The American Academy of Periodontology, Chicago (Avril 1995)
[3]
The American Academy of Periodontology
Proceedings of the World Workshop in ClinicalPeriodontics
The American Academy of Periodontology, Chicago (1989), pp. I/23-I/24
[4]
G.C Armitage
Development of a classification system for periodontaldiseases and conditions
Ann Periodontol, 4 (1999), pp. 1-6
CrossrefView in ScopusGoogleScholar
[5]
J.M Goodson, A.C Tanner, A.D Haffajee, G.C Sornberger, S.S Socransky
Patterns of progression and regression of advanced destructive periodontaldisease
J Clin Periodontol, 9 (1982), pp. 472-481
[6]
J Lindhe, A.D Haffajee, S.S Socransky
Progression of periodontaldisease in adultsubjects in the absence of periodontaltherapy
J Clin Periodontol, 10 (1983), pp. 433-442
[7]
S.S Socransky, A.D Haffajee, J.M Goodson, J Lindhe
New concepts of destructive periodontaldisease
J Clin Periodontol, 11 (1984), pp. 21-32
[8]
M.K Jeffcoat, M.S Reddy
Progression of probingattachmentloss in adultperiodontitis
J Periodontol, 62 (1991), pp. 185-189
View at publisherCrossrefView in ScopusGoogleScholar
[9]
A Badersten, R Nilveus, J Egelberg
Effect of nonsurgicalperiodontaltherapy. V. Patterns of probingattachmentloss in non-responding sites
J Clin Periodontol, 12 (1985), pp. 270-282
[10]
P Lemaitre, C Bassede
Intérêt de l’étude de la microflore parodontale en microscopie directe : Le point 10 ans après Listgarten et Hellden
J Parodontol, 7 (1988), pp. 397-407
[11]
L Cohen, T Rams, J Slots, C Walker
Independent analyses of microbiologicalsamples by threetestinglaboratories
J Dent Res, 80 (2001), p. 219
[12]
W.J Loesche, D.E Lopatin, J Stoll, N van Poperin, P Hujoel
Comparison of variousdetectionmethods for periodontopathicbacteria: can culture beconsidered the primaryreference standard?
J Clin Microbiol, 30 (1992), pp. 418-426
CrossrefView in ScopusGoogleScholar
[13]
A.C Tanner, M.F Maiden, J.J Zambon, G.S Thoren, R.L Kent
Rapid chair-side DNA probe assay of Bacteroidesforsythus and Porphyromonasgingivalis
J PeriodontalRes, 33 (1998), pp. 105-117
View at publisherCrossrefView in ScopusGoogleScholar
[14]
G Conrads
DNA probes and primers in dental practice
Clin Infect Dis, 35 (2002), pp. S72-S77
[15]
G.R Persson, R.C Page
Diagnostic characteristics of crevicularfluid aspartate aminotransferase (AST) levelsassociatedwithperiodontaldiseaseactivity
J Clin Periodontol, 19 (1992), pp. 43-48
[16]
W.J Loesche, W.A Bretz, D Kerschensteiner, J Stoll, S.S Socransky, P Hujoel, et al.
Development of a diagnostic test for anaerobicperiodontal infections based on plaque hydrolysis of benzoyl–DL–arginine–naphthylamide
J Clin Microbiol, 28 (1990), pp. 1551-1559
CrossrefView in ScopusGoogleScholar
[17]
B.M Eley, S.W Cox
Advances in periodontaldiagnosis. 7. Proteolytic and hydrolytic enzymes linkwithperiodontitis
Brit Dent J, 184 (1998), pp. 323-328
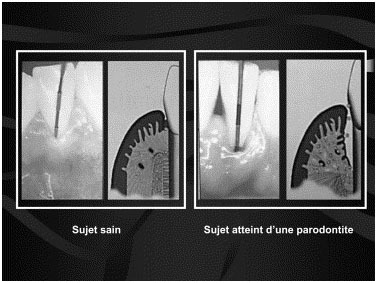
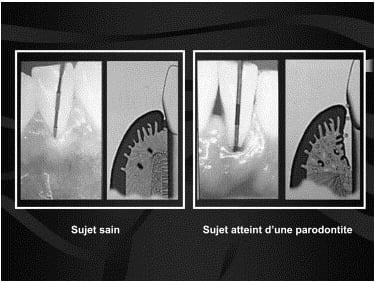
Exemple de routine quotidienne pour une hygiène bucco-dentaire impeccable
+
+
Continuez la lecture...
© 2024. All rights reserved.